來源:藥智網/中(zhōng)華小(xiǎo)吃
近日,CDE官網相繼發布多(duō)個技(jì )術指導原則,其中(zhōng)《化學(xué)仿制藥晶型研究技(jì )術指導原則(征求意見稿)》最受關注。晶型研究看似簡單,但經常會給技(jì )術人員帶來意想不到的困擾。可(kě)以肯定的說,一名(míng)經驗豐富的原料藥研發人員,一定會遇到晶型方面的麻煩;且晶型應該研究到怎樣的一個深度,更是一個沒有(yǒu)标準答(dá)案的問題。故,此時CDE發布該指導原則,具(jù)有(yǒu)很(hěn)好的指導意義。PS:近期CDE的發補文(wén)件已有(yǒu)要求晶型方面的深入研究。
晶型為(wèi)什麽要研究?
晶型研究,不僅是行業技(jì )術上的精(jīng)益求精(jīng),同時也是藥品質(zhì)量安(ān)全的重要保障。
技(jì )術上,現代化學(xué)藥物(wù)發展經曆了天然産(chǎn)物(wù)及粗制劑、單一化合物(wù)藥物(wù)制劑、高純度藥物(wù)、手性藥物(wù),直到今天的晶型藥物(wù)。
質(zhì)量安(ān)全方面,國(guó)外代表案例為(wèi)利托那韋因晶型出現問題導緻的撤市、重新(xīn)研究處方、再上市;國(guó)内代表案例如無味氯黴素、利福平等等。故,晶型研究不到位,将嚴重影響藥品的安(ān)全、有(yǒu)效、質(zhì)量可(kě)控。
晶型問題,CDE一直在關注
關于晶型研究,CDE對行業給出的指導,實際上于近20年内已經在多(duō)個指導文(wén)件中(zhōng)提及。當然,各階段所推薦的研究方式,極具(jù)體(tǐ)現當時的技(jì )術背景和行業發展特征;具(jù)體(tǐ)文(wén)件有(yǒu)《新(xīn)藥(化學(xué)藥品)補充申請指導原則》、《化學(xué)藥物(wù)質(zhì)量控制研究技(jì )術指導原則》、《藥物(wù)晶型的分(fēn)析方法介紹》、《化學(xué)藥物(wù)穩定性研究的技(jì )術指導原則》、《Q6A(質(zhì)量标準)-新(xīn)原料藥和新(xīn)藥制劑的檢測方法和可(kě)接受标準》、《仿制藥晶型研究指導原則》、《化學(xué)藥物(wù)原料藥制備和結構确證研究的技(jì )術指導原則》等等。
而近期,從技(jì )術角度對于晶型研究介紹較多(duō)的,當屬中(zhōng)國(guó)藥典2020年版四部通則;但如果從科(kē)學(xué)性角度來看,本指導原則征求意見稿可(kě)以說是對晶型研究一次極好的研究思路總結。
《化學(xué)仿制藥晶型研究技(jì )術指導原則(征求意見稿)》重點内容分(fēn)析
1.原文(wén):申請人應基于風險評估的理(lǐ)念,在全面理(lǐ)解參比制劑目标質(zhì)量概況的基礎上,選擇适宜的晶型進行處方工(gōng)藝開發。
解讀:風險評估,評估的是參比制劑的目标質(zhì)量,不受限于原研API的開發晶型;适宜的晶型,是指在滿足質(zhì)量可(kě)控的基礎上,服務(wù)于制劑研究。
2.原文(wén):化學(xué)仿制藥晶型研究主要包括兩方面内容:一是原料藥多(duō)晶型的種類,重點晶型的制備、表征及理(lǐ)化性質(zhì)研究;二是原料藥多(duō)晶型對制劑工(gōng)藝和療效等可(kě)能(néng)産(chǎn)生的影響,根據研究結果選擇适宜晶型。
解讀:多(duō)晶型研究,不應止步于與原研一緻的晶型研究即結束,還需深入研究多(duō)晶現象及制備;晶型對制劑工(gōng)藝和療效的影響,應具(jù)備一定的研究基礎,并依據結果說明晶型選擇的理(lǐ)由。
3.原文(wén):晶型篩選應關注在原料藥和制劑制備和貯存過程中(zhōng)可(kě)能(néng)會生成或轉化的晶型。對于仿制藥,通常情況下應選擇與參比制劑一緻的晶型,若有(yǒu)足夠的試驗數據證實其他(tā)晶型制備的仿制藥與參比制劑生物(wù)等效且具(jù)有(yǒu)合适的穩定性,也可(kě)選擇與參比制劑不同的晶型。無論選擇何種晶型,均應對所選擇晶型進行充分(fēn)的理(lǐ)化性質(zhì)和穩定性研究。
解讀:關注轉晶,評估風險;仿制藥通常還是優選與原研一緻的晶型,如有(yǒu)更優晶型,并應用(yòng)于制劑開發,需要進行充分(fēn)的研究。原料藥和制劑的開發,通常是分(fēn)工(gōng)進行的,甚至API源于外包,晶型往往早已确定;但,國(guó)内仿制藥企業近年已有(yǒu)品種規避了原研的晶型,并成功上市銷售。這也進一步證明,國(guó)内藥企對于仿制藥-藥物(wù)的質(zhì)量理(lǐ)解,正在不斷提升,且敢于突破。
4.原文(wén):對于仿制固體(tǐ)制劑、半固體(tǐ)制劑和混懸劑,應主要考慮晶型對原料藥及制劑工(gōng)藝和穩定性的影響,以及對制劑溶出和生物(wù)利用(yòng)度/生物(wù)等效性的影響,在充分(fēn)研究晶型對其影響的基礎上,确定是否有(yǒu)必要對藥物(wù)的晶型進行控制。對于液體(tǐ)制劑(如口服液、注射液等),建議關注原料藥的不同晶型對制劑工(gōng)藝過程可(kě)能(néng)産(chǎn)生的影響。
解讀:固體(tǐ)藥物(wù),是否需要進行可(kě)控的、深入的晶型研究,其核心是基于生物(wù)利用(yòng)度和生物(wù)等效性的數據結果,“因”和“果”要分(fēn)清;同時,液體(tǐ)制劑,也是要對晶型進行研究的,不能(néng)認為(wèi)其最終是溶解使用(yòng),就不進行一定的研究。
5.原文(wén):原料藥不同晶型的表觀溶解度存在差異時,建議申請人關注這種差異是否會影響制劑生物(wù)利用(yòng)度/生物(wù)等效性。另,生物(wù)藥劑學(xué)分(fēn)類(BCS)可(kě)科(kē)學(xué)地評價多(duō)晶型現象對制劑生物(wù)利用(yòng)度/生物(wù)等效性影響程度,使用(yòng)BCS分(fēn)類進行評估時,應自證拟開發品種的BCS分(fēn)類。
解讀:晶型不同,會在一定程度上影響溶解和溶出,繼而影響生物(wù)利用(yòng)度/生物(wù)等效性,這是晶型質(zhì)量的本質(zhì)所在。BCS分(fēn)類,自證,再利用(yòng)本指南給出的決策樹,可(kě)以滿足當前研發的邏輯基礎。
6.原文(wén):在證明仿制藥與參比制劑體(tǐ)内生物(wù)等效後,溶出度檢查可(kě)用(yòng)于評價仿制藥的批間一緻性。當晶型轉變可(kě)能(néng)影響制劑的生物(wù)利用(yòng)度或生物(wù)等效性時,可(kě)通過溶出度檢查作(zuò)為(wèi)監控方法,但應提供研究資料論證所用(yòng)溶出方法能(néng)反映上述變化。
解讀:溶出度,是制劑研究的重要内容,也是晶型質(zhì)量的重要證明依據,但最直接的證明是批次間的一緻性,并非晶型的一緻性!如果存在轉晶可(kě)能(néng),甚至轉晶對質(zhì)量存在重大影響,溶出相關的工(gōng)作(zuò)還需要做的更深入一些。
7.原文(wén):原料藥經幹燥、粉碎、制粒和壓片等制劑工(gōng)藝步驟,在溫度和濕度等環境因素的作(zuò)用(yòng)下,均可(kě)能(néng)出現轉晶現象,其晶型轉變的程度往往取決于不同晶型的相對穩定性、相轉變能(néng)壘,以及外加應力。應對工(gōng)藝過程中(zhōng)晶型轉變情況進行充分(fēn)的研究。
解讀:一般情況,原料藥的晶型研究,申報資料羅列的是不同晶型的制備方法,很(hěn)少對轉晶做出深入研究;而原料藥加工(gōng)到制劑,轉晶概率大幅度提升,故對于存在轉晶的API,應該進行充分(fēn)研究,以保證API的質(zhì)量可(kě)控。
8.原文(wén):決策樹采納的理(lǐ)論框架主要是基于多(duō)晶型影響制劑生物(wù)等效性/生物(wù)利用(yòng)度的潛在因素而建構,但建議申請人仍要考慮多(duō)晶型對制劑工(gōng)藝穩健性産(chǎn)生的影響,以及對制劑穩定性産(chǎn)生的影響。
解讀:以往的制劑研究,大都是在單一晶型基礎之上,進行開發;制劑研發人員通常不會接受不同晶型的API,所以無法給出不同晶型API所開發的制劑工(gōng)藝結果;本次指南建議申請人進行多(duō)晶型制劑工(gōng)藝研究,客觀講,如按此實施,無疑将投入更多(duō)甚至是成倍的研發成本。
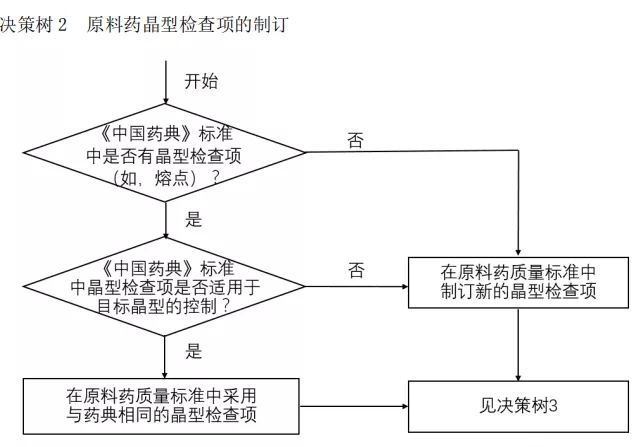
9.原文(wén):如果選擇的是亞穩态晶型,由于亞穩态晶型可(kě)能(néng)在制劑工(gōng)藝和貯存過程中(zhōng)發生晶型轉變,需要進行相關研究并依據研究情況決定是否在制劑質(zhì)量标準中(zhōng)制訂晶型檢查項。
解讀:近年來,越來越多(duō)的藥物(wù)為(wèi)難溶性藥物(wù),BCSII類藥物(wù)占比較大,通常制劑采用(yòng)溶出控制,來替代晶型控制;如果需要進一步的對晶型進行控制,那就需要制訂固态表征檢測項。固态表征最主要的痛點就是輔料的幹擾,進而就需要開發方法,而在這一過程中(zhōng),是非常需要前期原料藥的多(duō)晶研究結果,否則,方法的開發是很(hěn)容易不夠全面的!尤其是不易察覺、結果極為(wèi)接近的轉晶、混晶。
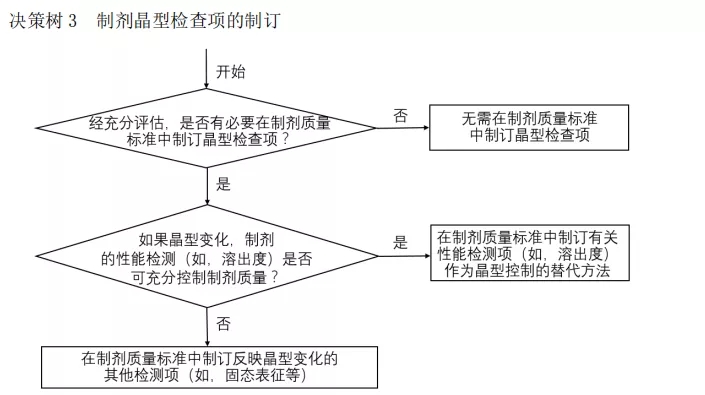
10.原文(wén):國(guó)際公(gōng)認用(yòng)于物(wù)相分(fēn)析的方法也可(kě)對晶型進行定性或定量分(fēn)析,确保原料藥或制劑中(zhōng)有(yǒu)效晶型的含量。常用(yòng)的定量方法包括:粉末X射線(xiàn)衍射法(PXRD)、紅外光譜法(IR)、差示掃描量熱法(DSC)、拉曼光譜法(Raman)、固體(tǐ)核磁共振波譜法(ssNMR)等。
解讀:這裏提到了晶型的定量問題。注冊申報資料中(zhōng)的晶型研究部分(fēn),現下幾乎全部都是定性研究數據;多(duō)晶研究的信息本就不多(duō),更何況是定量研究;但似乎,這是藥品未來質(zhì)量研究的一個重要方向(但不确定是否會是必須項)。現在已經有(yǒu)很(hěn)多(duō)研究,對API的晶型進行了定量研究,但尚未上升到一定的高度,工(gōng)業界也尚未重視晶型的定量,更多(duō)的是學(xué)術界做論文(wén)較多(duō);這個點,值得形成一定的知識儲備,可(kě)以适當進行一定的工(gōng)作(zuò),絕對會利于對最終藥物(wù)的質(zhì)量研究。
結語
總的來說,CDE發布該指南,可(kě)以更好地指導仿制藥研究者,理(lǐ)解藥物(wù)晶型的真正用(yòng)途,并建議仿制藥晶型研究不能(néng)過于SOP化;此外,明确了許多(duō)晶型研究的邏輯,尤其是決策樹的給出,将顯著提高“及格線(xiàn)”的研究水平。另,本次指南全部針對的是仿制藥的晶型研究,而當下正在成倍遞增的創新(xīn)藥晶型研究,業界更需要指南,如能(néng)借此機會再上升一個程度,再來個決策樹,無疑将進一步促進藥品的全生命晶型研究。

