7月17日,國(guó)家藥監局就上市許可(kě)持有(yǒu)人制度再次發函。回複了上市許可(kě)持有(yǒu)人和生産(chǎn)企業各自的權責問題。

據悉,上市許可(kě)持有(yǒu)人制度試點将實施至2018年11月4日,随後将在完善後全國(guó)推廣。也就是說,4個月之後,上市許可(kě)持有(yǒu)人制度的下一步走向就将明确。
據清華大學(xué)法學(xué)院教授王晨光撰文(wén),藥品上市許可(kě)持有(yǒu)人制度是我國(guó)藥品注冊制度的新(xīn)核心,将對我國(guó)醫(yī)藥産(chǎn)業從研發到監管産(chǎn)生深刻影響。
▍藥品上市許可(kě)持有(yǒu)人制度
藥品上市許可(kě)持有(yǒu)人制度,在我國(guó)開始于2015年。
2015年11月4日,第十二屆全國(guó)人民(mín)代表大會常務(wù)委員會第十七次會議“授權國(guó)務(wù)院在北京、天津、河北、上海、江蘇、浙江、福建、山(shān)東、廣東、四川十個省、直轄市開展藥品上市許可(kě)持有(yǒu)人制度試點,允許藥品研發機構和科(kē)研人員取得藥品批準文(wén)号,對藥品質(zhì)量承擔相應責任。”
随後,國(guó)務(wù)院于2016年6月6日正式發布《藥品上市許可(kě)持有(yǒu)人制度試點方案》(國(guó)辦(bàn)發〔2016〕41号,以下簡稱《方案》)。
據悉,上市許可(kě)持有(yǒu)人制度是修訂後的《藥品管理(lǐ)法》的核心制度之一,進而在我國(guó)藥品領域全面推廣實施。我國(guó)藥品注冊制度将形成以藥品上市許可(kě)持有(yǒu)人制度為(wèi)中(zhōng)心的新(xīn)制度。
與歐、美、日等藥品産(chǎn)業發達國(guó)家和地區(qū)不同,在我國(guó)現行藥品注冊制度是上市許可(kě)與生産(chǎn)許可(kě)“捆綁制”的管理(lǐ)模式,也就是說,藥品上市許可(kě)(藥品批準文(wén)号)隻頒發給具(jù)有(yǒu)《藥品生産(chǎn)許可(kě)證》的生産(chǎn)企業,藥品研發機構、科(kē)研人員則不具(jù)備獨立獲取藥品上市許可(kě)的資質(zhì)。
而所謂藥品上市許可(kě)持有(yǒu)人制度,通常指擁有(yǒu)藥品技(jì )術的藥品研發機構、科(kē)研人員、藥品生産(chǎn)企業等主體(tǐ),通過提出藥品上市許可(kě)申請并獲得藥品上市許可(kě)批件,并對藥品質(zhì)量在其整個生命周期内承擔主要責任的制度。
▍明确責任主體(tǐ),釋放研發活力
在該制度下,上市許可(kě)持有(yǒu)人和生産(chǎn)許可(kě)持有(yǒu)人可(kě)以是同一主體(tǐ),也可(kě)以是兩個相互獨立的主體(tǐ)。根據自身狀況,上市許可(kě)持有(yǒu)人可(kě)以自行生産(chǎn),也可(kě)以委托其他(tā)生産(chǎn)企業進行生産(chǎn)。
如果委托生産(chǎn),上市許可(kě)持有(yǒu)人依法對藥品的安(ān)全性、有(yǒu)效性和質(zhì)量可(kě)控性負全責,生産(chǎn)企業則依照委托生産(chǎn)合同的規定就藥品質(zhì)量對上市許可(kě)持有(yǒu)人負責。
可(kě)見,上市許可(kě)持有(yǒu)人制度與現行藥品注冊許可(kě)制度的最大區(qū)别不僅在于獲得藥品批準文(wén)件的主體(tǐ)由藥品生産(chǎn)企業擴大到了藥品研發機構、科(kē)研人員,而且對藥品質(zhì)量自始至終負責的主體(tǐ)也更為(wèi)明确,從而有(yǒu)利于确保和提升藥品質(zhì)量。
也就是說,以藥品上市許可(kě)持有(yǒu)人制度試點為(wèi)突破口,我國(guó)藥品注冊制度将由上市許可(kě)與生産(chǎn)許可(kě)的“捆綁制”,向上市許可(kě)與生産(chǎn)許可(kě)分(fēn)離的“上市許可(kě)持有(yǒu)人制度”轉型。
目前,試點藥品範圍主要包括試點方案實施後批準上市的新(xīn)藥、按新(xīn)标準批準的仿制藥以及試點方案實施前已批準上市的部分(fēn)藥品。不包括麻醉藥品、精(jīng)神藥品、醫(yī)療用(yòng)毒性藥品、放射性藥品、預防用(yòng)生物(wù)制品、血液制品。
據悉,《藥品上市許可(kě)持有(yǒu)人制度試點方案》(以下簡稱《試點方案》)自印發之日起,實施至2018年11月4日。
試點工(gōng)作(zuò)期間核發的藥品批準文(wén)号,試點期滿後,在藥品批準證明文(wén)件載明的有(yǒu)效期内繼續有(yǒu)效。
試點工(gōng)作(zuò)結束後,食品藥品監管總局将及時總結試點經驗,對于實踐證明可(kě)行的做法,及時提出修改完善《藥品管理(lǐ)法》《藥品管理(lǐ)法實施條例》等法律、法規的建議,并修改完善相關部門規章,以便适時在全國(guó)範圍内針對所有(yǒu)藥品品種全面推行藥品上市許可(kě)持有(yǒu)人制度。
▍165個品種已申報
自上市許可(kě)持有(yǒu)人制度試點推行以來,一批藥品已經申報成功。
2017年4月20日,原國(guó)家食藥監總局官網發通知,首個上市許可(kě)持有(yǒu)人制度試點品種獲批。
具(jù)體(tǐ)信息如下:
浙江醫(yī)藥股份有(yǒu)限公(gōng)司新(xīn)昌制藥廠的蘋果酸奈諾沙星原料藥及其膠囊劑經國(guó)家食品藥品監管總局批準取得了藥品上市許可(kě)持有(yǒu)人制度試點品種,浙江醫(yī)藥股份有(yǒu)限公(gōng)司新(xīn)昌制藥廠為(wèi)本品上市許可(kě)持有(yǒu)人。
蘋果酸奈諾沙星是一種新(xīn)型的無氟喹諾酮類抗菌藥物(wù),是國(guó)家食品藥品監管總局自藥物(wù)臨床試驗數據自查核查以來首個獲批的創新(xīn)藥。
截至2016年12月25日,據食藥監統計,10個試點省份藥品上市許可(kě)持有(yǒu)人試點品種申報數量共165。
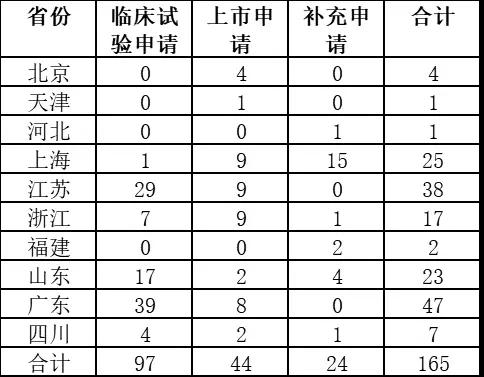
(圖表制作(zuò):賽柏藍)
從這一數字可(kě)以看出,随着上市許可(kě)持有(yǒu)人制度的全國(guó)推行,我國(guó)新(xīn)藥上市将迎來難得機遇期。